All’inizio
del XIX secolo si delinea la prima descrizione formale della teoria atomica
della materia (J. Dalton 1803-1808) che è in accordo con le precedenti leggi
della conservazione delle masse (A. Lavoiser,
1789) e delle proporzioni multiple (J.L. Proust, 1799). Secondo tale
teoria la materia è composta da atomi, particelle microscopiche indivisibili e
indistruttibili che risultano indistinguibili (hanno quindi stessa massa) per
uno stesso elemento, non possono essere creati o distrutti, si combinano tra
loro (anche con quelli di altri elementi) per formare i composti e sono in
grado di essere eventualmente trasferiti da un composto all’altro.
Una
più precisa teoria atomica permette di determinare il peso atomico degli elementi
(S. Cannizzaro, 1858) che sono così riordinati – con peso atomico crescente e
incolonnati per proprietà chimiche simili – evidenziando una periodicità ricorrente rappresentata in
una tavola periodica (D. I. Mendeleev, 1869). E non tutte le case della tavola
periodica devono essere necessariamente piene
perché alcuni elementi sono ancora da scoprire.
La discussione derivante dalla rilevazione dei
raggi catodici (E. Goldstein, 1876; W. Crookes, 1880), un fascio di elettroni
(J.J. Thomson, 1898), l’osservazione dei raggi canali o anodici riconosciuti come
ioni positivi – atomi privati di uno o più elettroni – (E. Goldstein, 1886), nonché
la successiva definizione del protone [1] decretano
la nascita di quella branca della fisica conosciuta come fisica atomica.
Elettroni
e protone cancellano il concetto di indivisibilità dell’unità fondamentale
della materia lasciando aperto il confronto per ipotizzarne una struttura.
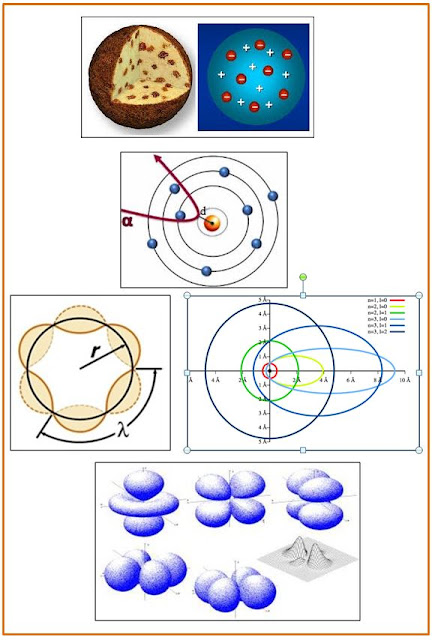
Il
primo modello atomico (J.J. Thomson, 1898), in cui le cariche negative sono
distribuite e controbilanciate in una sfera omogenea positiva (una sorta di
panettone con gli elettroni che rappresentano gli acini di uvetta) è
sostituito, dopo l’esperimento che impiega particelle alfa come sonda, dal
modello atomico planetario (E. Rutherford, 1911). In tale esperimento si
utilizza, per la prima volta, un fascio di particelle proiettile provenienti dal decadimento radioattivo
(di radio) inviate perpendicolarmente ad atomi bersaglio rappresentati da un sottile foglio d’oro avvolto in altro
materiale ricoperto di solfuro di zinco, usato come rivelatore. È stato
osservato che una particella su ottomila era riflessa ad angoli maggiori di
90°. [2]
Ipotizzando un piccolo nucleo centrale,
pesante e compatto, con gli elettroni che vi gravitano attorno è possibile
spiegare la diffusione osservata. Il modello atomico planetario così descritto è sì in accordo con le leggi della
meccanica, ma non con quelle dell’elettrodinamica. L’elettrone, di cui è stata
frattanto misurata la carica (R.A. Millikan, 1909),[3]
non può girare attorno al nucleo senza irradiare energia sotto forma di onde
elettromagnetiche. Proprio perché elettricamente carico l’elettrone dovrebbe,
infatti, durante il suo movimento di moto non rettilineo e uniforme [4],
irradiare energia; e questa sua perdita di energia dovrebbe costringerlo,
seguendo un percorso a spirale, a cadere sul nucleo emettendo radiazioni a
tutte le lunghezze d’onda corrispondenti alle (infinite) posizioni occupate nel
suo percorso. [5]
L’idea di applicare il quanto di energia alla
struttura elettronica dell’atomo attraverso il concetto di orbite circolari quantizzate
(N. Bohr, 1913), identificando stati stazionari discreti, con un preciso contenuto
di energia e nei quali l’elettrone non emette radiazione elettromagnetica,
indica la strada da percorrere per una possibile soluzione. Il motivo per il
quale l’elettrone ruotando attorno al nucleo si presenta in uno stato
stazionario è dovuto al fatto che la lunghezza della circonferenza dell’orbita 2πr risulta essere multiplo intero del
valore quantizzato nh/mv ovvero mvr = nh/2πmv (dove m è la massa,
v la velocità, r il raggio dell’orbita e n
è un numero intero da 1 a ¥ e identifica il numero dell’orbita, il suo contenuto
energetico).[6]
L’elettrone può inoltre assorbire energia
solo se questa è sufficiente a far avvenire la transazione dell’elettrone dalla
prima alla seconda orbita; l’elettrone, con un salto quantico, varia il suo
stato energetico da fondamentale ad eccitato ma ritornerà (dopo circa 10-9
s) allo stato iniziale restituendo
l’energia in eccesso sottoforma di radiazione elettromagnetica, in sintonia con
gli spettri caratteristici di ogni elemento.
Questo
modello, che bene si adatta all’atomo di idrogeno e solo in parte ad alcuni
metalli alcalini, sarà modificato introducendo orbite a diversa ellitticità (A. Sommerfeld, 1915) aggiungendo, quindi, un
secondo numero quantico, nel tentativo, parzialmente
soddisfatto, di spiegare gli spettri degli altri elementi. L’originale
spiegazione (H.A. Lorentz, 1900) del cosiddetto effetto Zeeman (P. Zeeman,
1896), cioè la suddivisione in triplette di una riga dello spettro della
radiazione emessa da una sorgente posta in prossimità di un forte campo
magnetico, è dovuta ad un terzo numero quantico che indica l’orientamento del
campo magnetico creato dall’elettrone durante il suo orbitare attorno al
nucleo.
Naturalmente è lecito chiedersi perché gli
elettroni devono avere una preferenza
per queste orbite, per un particolare momento angolare, legato al valore della
costante di Planck.
Nel
caso delle onde elettromagnetiche tale costante ha introdotto l’aspetto
corpuscolare delle onde.[7]
Perché non chiedersi se, questa volta, la
relazione con la costante di Planck non spieghi per caso l’aspetto ondulatorio di
un corpuscolo cioè dell’elettrone?[8]
Se l’esistenza degli stati stazionari
nell’atomo è spiegato utilizzando il quanto d’azione per giustificare le
proprietà dell’elettrone, perché non assegnare all’elettrone un dualismo
corpuscolo-onda cioè un aspetto ondulatorio?
È dunque possibile ipotizzare che le
condizioni di quantizzazione conducano all’introduzione di una componente
ondulatoria degli elettroni in modo che la lunghezza d’onda di questo aspetto ondulatorio abbia un valore tale
per cui l’orbita (2πr) ne contiene un
numero intero, multiplo di h/mv così
che possano sussistere gli stati stazionari: l’elettrone avrà un duplice
aspetto, corpuscolare e ondulatorio, fondato sul quanto di azione.
Proprio
come ad ogni frequenza delle onde elettromagnetiche corrisponde un fotone con
una determinata energia che ne evidenzia la caratteristica corpuscolare (p=h/λ), ad
ogni particella di materia, con una determinata energia e quantità di moto, è
associata un’onda caratteristica, una
vibrazione, la cui lunghezza è definita dalla costante di Planck diviso la
quantità di moto della particella stessa (L. De Broglie, 1924):
l
= h/p
Dato
il piccolissimo valore della costante di Planck si capisce che è vano il
tentativo di rilevare le onde di materia per oggetti di massa del nostro mondo
quotidiano. Una palla del peso di 1 kg che rotola ad una velocità di 1 m/s (circa 3,6 km/h, la velocità alla quale normalmente si passeggia) produce una
lunghezza d’onda pari a 6,6
*10-34 m: davvero troppo piccola per essere
rilevata! [9]
Poiché
le onde di materia hanno, di fatto, una lunghezza d’onda inversamente
proporzionale alla quantità di moto, questa si dovrebbe manifestare, per
elettroni lenti, in una regione di onde rilevabili sperimentalmente (L. de
Broglie, 1924). Bombardando con elettroni dei cristalli di nichel sono state
rilevate figure di interferenza sulla pellicola posta dietro al metallo,
proprio come se il nichel fosse attraversato da onde, da raggi X, appunto, anziché da elettroni (C.J.
Davisson, L. H. Germer; G.P. Thomson; 1927). La proprietà ondulatoria della
materia si è dunque manifestata per gli
elettroni con un fenomeno legato alle onde, la diffrazione, e la materia ha
davvero aspetti ondulatori!
Le
onde di materia sono associate al movimento di qualsiasi corpo ma,
all’aumentare della massa e/o della velocità, diminuiscono rapidamente la loro
lunghezza d’onda, tanto da far manifestare solo le proprietà corpuscolari. È proprio
del tutto simile al caso diametralmente opposto in cui le onde
elettromagnetiche manifestano in modo più evidente la loro seconda natura,
quella corpuscolare, solo al di sopra di una certa frequenza, in virtù della
quale sono capaci di espellere elettroni da un metallo dando luogo all’effetto
fotoelettrico.
Ma
come possono le onde, alle quali sono associate i fenomeni di interferenza e
diffrazione, manifestare proprietà tipiche dei corpuscoli? Nondimeno, come può
l’elettrone, che è tipicamente un corpuscolo con massa e carica elettrica,
avere proprietà ondulatorie?
La
luce manifesta aspetti corpuscolari e aspetti ondulatori o, meglio, le onde
elettromagnetiche manifestano proprietà ondulatorie e corpuscolari così come le
particelle hanno proprietà corpuscolari e ondulatorie: secondo il principio
della complementarietà (N. Bohr, 1927), l’osservazione di uno dei due aspetti
della stessa realtà fisica esclude l’osservabilità dell’altra.
Nel
mondo quotidiano le proprietà ondulatorie delle onde elettromagnetiche, quali
ad esempio le onde radio, prevalgono su quelle dei corpuscoli perché l’energia
dei fotoni interessati è mediamente molto piccola. E negli oggetti prevalgono
le proprietà corpuscolari perché la lunghezza d’onda dell’onda associata è
trascurabile se confrontata con le dimensioni dell’oggetto considerato e
determina, in pratica, un continuo. Nel microcosmo, invece, a causa delle
piccolissime masse in gioco, la lunghezza d’onda dell’onda di materia assume un
significato importante perché ha dimensioni paragonabili a quella dell’oggetto
d’indagine. [10]
Il
fatto di dover rinunciare, su scala atomica, alla netta distinzione tra onde e
corpuscoli (giacché le onde manifestano proprietà corpuscolari e i corpuscoli
si comportano come delle onde) evidenzia l’impossibilità di descrivere
contemporaneamente questo doppio aspetto della natura definendo il limite,
l’indeterminazione, dell’informazione ottenibile sperimentalmente.[11]
La
struttura elettronica dell’atomo, il concetto di orbite quantizzate, trova
dunque adeguato sostegno attraverso l’idea delle onde di materia della meccanica ondulatoria. Le condizioni di
quantizzazione del momento angolare non sono imposte ma derivate dalla natura
ondulatoria dell’elettrone e le orbite contengono un numero intero di lunghezze
d’onda pari a l = h/mv; l’elettrone può muoversi intorno al
nucleo con questa lunghezza d’onda che è quella di un’onda stazionaria e, in
questo modo, non irradia energia.
Il
dualismo corpuscolo-onda riesce a fornire una descrizione dell’elettrone in
termini di onda [12]
ma, in questo modo, non sarà possibile calcolare con precisione il raggio
dell’orbita e l’impulso dell’elettrone: il modello ad orbite quantizzate è allora
in contraddizione con il principio di indeterminazione.
Come
fare dunque a descrivere l’evoluzione delle onde di materia nel tempo? L’idea
del dualismo corpuscolo-onda trova la giusta dimensione matematica attraverso
due vie: le equazioni di Schrödinger (E. Schrödinger, 1925) e la meccanica
delle matrici (W. Heisenberg, 1925). Le due soluzioni sono equivalenti dal
punto di vista fisico e descrivono la meccanica ondulatoria non relativistica.
È
stata l’equazione di Schrödinger a diffondersi più rapidamente rispetto alla
meccanica delle matrici. Tale equazione, una funzione d’onda definita
convenzionalmente Y (psi), descrive il
propagarsi dell’onda associata al movimento di ogni particella. E se le
particelle libere possono avere qualsiasi valore di energia e velocità – in
quest’ultimo caso il limite massimo è rappresentato dalla velocità della luce –
la situazione cambia radicalmente nel caso di particelle sulle quali agiscono
delle forze. È questo il caso degli stati stazionari, quali l’elettrone
nell’atomo, per i quali la funzione d’onda Y è diversa da zero e ha
quindi significato solo per determinati valori di energia. Le soluzioni delle
equazioni di Schödinger definiscono perciò gli stati stabili dei sistemi fisici
e la funzione Y rende matematicamente
conto alle orbite quantizzate che garantiscono la solidità atomica.
L’atomo
risulta composto da nuclei puntiformi pesanti, dove è racchiusa la carica
positiva, e da elettroni, con carica negativa, che avvolgono il nucleo secondo
le equazioni di Schrödinger che vincola l’onda elettronica in una particolare
configurazione energetica che può essere rappresentata attraverso tre numeri
quantici che identificano, rispettivamente, la distanza dal nucleo, la forma e
l’orientamento spaziale delle orbite.
Il numero quantico principale, indicato dalla
lettera n, chiarisce il livello
energetico dell’elettrone proporzionalmente alla sua distanza dal nucleo, può
assumere solo valori interi da 1 a + ¥.
Più alto è il numero più grandi sono gli orbitali e più aumenta la loro
energia; spesso anziché utilizzare i numeri per i differenti strati di energia si usano le lettere K, L, M, N, O...
Il numero quantico secondario, o angolare o
azimutale, rappresentato con la lettera l,
assume tutti i valori compresi in n-1
cioè 0, 1, 2, 3... Questo numero quantico, scritto frequentemente con le
lettere s, p, d, f, g... specifica le
caratteristiche geometriche dell’orbitale. Così, ad esempio, l’orbitale s ha la forma di una nuvola sferica (di
probabilità) e l’orbitale p ha la
forma di due lobi (a forma di 8) per le tre dimensioni dello spazio.
Il numero quantico magnetico, ml, è il numero dei
differenti orientamenti che l’orbitale può assumere per effetto di un campo
magnetico esterno con un valore massi mari a 2l+1, con valori compresi tra + l
e -l.
Un quarto numero quantico è necessario e
specifico per l’elettrone. La suddivisione delle triplette in ulteriori righe,
cioè l’effetto Zeeman anomalo, la struttura fine delle righe spettrali e gli
effetti giromagnetici, si spiegano solo con la supposizione della rotazione
dell'elettrone sul proprio asse (G.E. Uhlenbeck, S.A. Goudsmit, 1925). Ed è
proprio questo concetto che giustifica la presenza di due elettroni nello
stesso orbitale. Si può formulare il quarto numero quantico attraverso il
principio di esclusione (W. Pauli, 1925): due elettroni possono occupare la
stessa orbita solo se hanno il valore dello spin opposto. Il numero quantico di
spin, ms, può assumere
solo due valori: +½ e -½.
L’interpretazione
fisica della meccanica ondulatoria (M. Born, W. Heisemberg, N. Bohr, 1926)
descrive il concetto di probabilità di transizione, cioè la probabilità in un
dato istante che un corpo possa essere associato ad una determinata posizione
nello spazio. Il quadrato della funzione d’onda Y descrive allora il
moto dei corpi in modo probabilistico. L’equazione di Schödinger è, di fatto,
l’ampiezza (l’intensità, l’energia) delle onde di materia e la particella avrà
più probabilità di essere localizzata nello spazio e nel tempo dove l’ampiezza
della funzione d’onda Y è grande. Allora gli
orbitali degli atomi altro non sono che la funzione d’onda Y a cui sono stati assegnati i valori dei
numeri quantici. E la funzione d’onda assume significato quando si considera un
intorno tanto ampio da avere un’alta probabilità che l’elettrone si trovi in
tale intorno. La probabilità di trovare l’elettrone in un dato punto dello
spazio può essere più o meno elevata e si parla impropriamente di forma dell’orbitale.
Frattanto,
mentre l’interesse generale è rivolto alla corteccia esterna dell’atomo, si
suggerisce l’esistenza di un’altra particella neutra situata nel nucleo – con
una dimensione più piccola di quella dell’atomo di idrogeno – e che deriverebbe
dalla combinazione di un protone ed un elettrone così da giustificare la presenza degli isotopi (E. Rutherford, 1920).
La scoperta del neutrone (J. Chadwick, 1932)
conferma che i nuclei, che hanno una dimensione da 10.000 a 100.000 volte
inferiore a quella dell’atomo, sono costituiti da protoni e neutroni in
opportune combinazioni tali da spiegare le tavole dei pesi e dei numeri
atomici.
Elettrone,
protone e neutrone – tre sole particelle – e un’unica forza, quella
elettromagnetica, per spiegare le molteplici proprietà della materia (la forza
gravitazionale è considerata solo nel macrocosmo).
Ma
se il microcosmo è costruito con tre particelle e governato da un’unica forza,
che agisce grazie al fotone, il problema della compattezza del nucleo non è comunque risolto: come possono stare
uniti assieme protoni e neutroni? I protoni si dovrebbero addirittura
respingere tra loro e sui neutroni, privi di carica elettrica, la forza elettromagnetica non può agire! È fin troppo evidente la criticità della
stabilità nucleare…
A
complicare ulteriormente questa visione c’è anche la problematica relativa al
decadimento b.
Lo studio dei raggi b
nel decadimento radioattivo ha già dimostrato che esso può avvenire secondo
un’ampia gamma di energie (J. Chadwick, 1913). L’energia di tali raggi sommata
a quella del nuovo nucleo prodotto (con numero atomico immediatamente superiore
a quello originario) non coincide però con l’energia dell’atomo radioattivo
prima del decadimento (J. Chadwick, C.D. Ellis, W. A. Wooster, 1929).
All’aumentare o al diminuire dell’energia dell’elettrone emesso nei raggi b
non corrisponde, come invece ci si aspetta, una minor o maggior energia del
nuovo nucleo prodotto. Come spiegare questa mancanza
di energia?
[1]
Lo studio sugli ioni positivi porta a suggerire il nome di
protone, dal greco pròton primo
(componente del nucleo) per la particella identificata come il nucleo
dell’atomo di idrogeno (E. Rutherford, 1919-1920).
[2] Il solfuro di zinco emette scintille
luminose quando viene colpito da particelle alfa; è consuetudine ricordare lo
stupore dello stesso Rutherford attraverso le sue parole “(…) è come sparare un proiettile da 15 pollici su un foglio di carta
velina e vederlo tornare indietro a colpirti (…).”
[4] Soggetto cioè ad accelerazione radiale.
[5] Tutto questo
forse sottovalutando la spiegazione di come possono restare unite in un nucleo
compatto particelle con la stessa carica elettrica senza subire l’effetto di
repulsione l’una con l’altra.
[7] L’effetto fotoelettrico assegna alla
propagazione delle onde elettromagnetiche un comportamento discontinuo, di tipo
corpuscolare e l’effetto Compton ne ha conferma la validità.
[8]
Più in generale, questo strano dualismo di onde e corpuscoli deve forse essere sempre
considerato ogni volta che ci ritroviamo
la costante di Planck?
[9] Anche riducendo
di 1.000.000 di volte la massa la lunghezza d’onda, pari a 6,6 *10-28,
non può essere rilevata.
[10] Sebbene i valori
trascurabili nella fisica classica assumono prepotentemente significato nel
microcosmo, il principio di corrispondenza dimostra che è sempre la meccanica
classica il limite a cui tende la meccanica quantistica quando si assegnano
valori molto grandi ai numeri quantici.
[11]
V. post il principio di indeterminazione.
[12] Come un
pacchetto di onde.

Nessun commento:
Posta un commento